로이터 통신에 따르면 이노비오는 26일 “브라질 의약품 규제당국으로부터 중후반 단계(mid-to-late stage) 임상 승인을 받았다”며 이같이 밝혔다.
앞서 이노비오는 올초 미 식품의약국(FDA)이 백신 전달 장치에 대한 추가 정보를 이유로 미국내 연구 일부를 중단한 뒤, 중후반 단계 임상을 미국 밖에서 실시하기로 결정한 바 있다.
이에 미국 정부도 미국 내 백신 연구를 명목으로 제공하던 말기 연구 자금 지원을 철회했다.
이노비오는 지금까지 전염병대비혁신연합(CEPI), 빌앤멜린다 게이츠 재단, 미 국방부로부터 약 8500만 달러(약 994억9250만원)의 코로나19 백신(INO-4800) 개발 지원금을 받았다.
이노비오 측은 중국 어드백신 생명공학과 제휴해 세계 각지에서 글로벌 효능 임상을 수행할 예정이라고 밝혔다.
한편 이노비오는 올가을부터 중국 시노백과도 교차접종 임상실험을 실시할 예정이다. ‘비활성화 백신’인 시노백과 DNA 백신인 이노비오 조합의 안전성과 효능을 알아본다는 취지다.
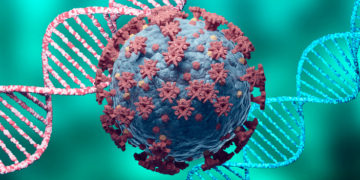
DNA 백신은 코로나19 바이러스의 표면항원 유전자(DNA)를 체내에 주입해 표면항원 단백질을 생성해 면역 반응을 유도하는 방식이다.
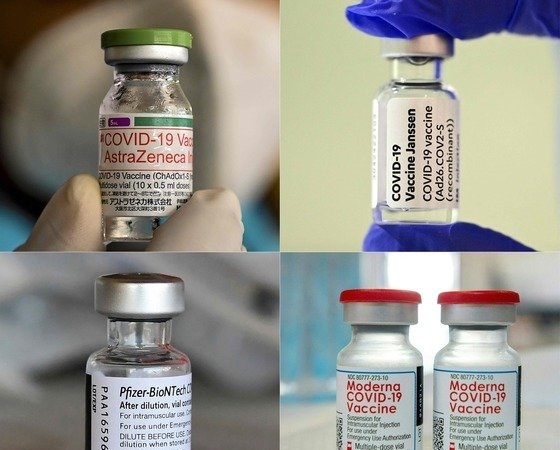
반면, 화이자와 모더나의 메신저리보핵산(mRNA) 백신은 코로나19 바이러스의 표면항원 유전자를 RNA 형태로 주입하는 방식이다.
아스트라제네카나 얀센, 스푸트니크V 등 바이러스벡터 백신은 코로나19 바이러스의 표면항원 유전자를 아데노바이러스 등 다른 바이러스 주형에 넣어 체내에 주입한다는 점에서 다르다.
이노비오 측은 자사의 DNA 백신이 콜드체인을 필요로 하지 않으며 내약성(tolerability), 균형잡힌 면역 반응, 강한 열안정성을 갖고 있다고 설명했다.
지금까지 DNA 코로나19 백신 또는 백신 후보 물질 가운데 사용 승인이 이뤄진 건 인도 지두스 카딜라의 백신 뿐이다.
앞서 인도 의약품 규제당국은 지난 20일 자국 제약사 카딜라의 DNA 기반 코로나19 백신의 12세 이상 접종에 대해 긴급 사용을 승인했다.
카딜라 백신은 주삿바늘이 없는 어플리케이터를 사용해 접종하며, 3회용으로 제조됐다는 점에서 기존 백신과 차별화됐다.
기사출처: 최서윤기자/뉴시스/美 이노비오 ‘DNA 백신’, 브라질서 임상 시작/기사입력 2021.08.26









![[인터뷰] 브라질 경제 연착륙 중… “재정 건전성이 향후 최대 변수”](https://bomdianews.com.br/wp-content/uploads/2026/03/Gemini_Generated_Image_1nh6v11nh6v11nh6-360x180.png)






![[포토] 동포사회 최대 축제 15회 한국문화의날 (1)](https://bomdianews.com.br/wp-content/uploads/2022/08/한국문화의날IMG_7780-360x180.jpg)









![[인터뷰] 브라질 경제 연착륙 중… “재정 건전성이 향후 최대 변수”](https://bomdianews.com.br/wp-content/uploads/2026/03/Gemini_Generated_Image_1nh6v11nh6v11nh6-350x250.png)



![[인터뷰] 브라질 경제 연착륙 중… “재정 건전성이 향후 최대 변수”](https://bomdianews.com.br/wp-content/uploads/2026/03/Gemini_Generated_Image_1nh6v11nh6v11nh6-120x86.png)


